
Protein A/G抗体纯化磁珠是由超顺磁性颗粒与protein A及 protein G共价偶联而成。Protein A/G对多个物种IgG的不变区域(Fc)具有很高亲和力,包括人类,狗和兔等。医脉赛Protein A/G抗体纯化磁珠具有快速磁响应性,高蛋白结合能力和低非特异性结合,可快速有效地从血清、腹水或细胞培养液等生物样品中分离和纯化免疫球蛋白,也可通过抗原抗体结合从生物样品中免疫沉淀靶蛋白。本产品可再生及再生后使用,用于高效抗体制备。
操作流程(示意图):
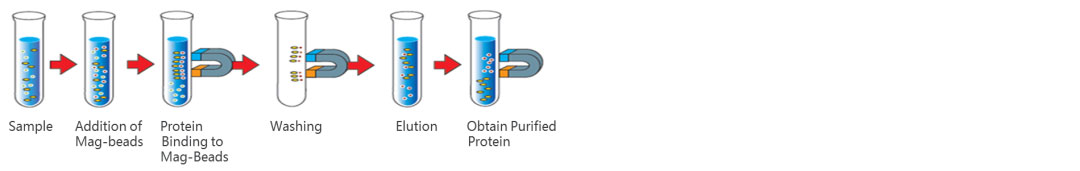
蛋白A/G(Protein A/G)抗体亲和磁珠从人血清样本中纯化抗体实例见下:


| 目录号 | 规格 | 适用机型 |
|---|---|---|
| AE03001 | 20mg/ml,1ml | 略 |
| AE03002 | 20mg/ml,5ml | 略 |
【手工实验步骤】
本实验步骤提供一般操作流程,实验具体条件可根据特定应用由用户进行优化,包括培养条件(浓度,时间和缓冲液)以及所需磁珠用量。
A. 抗体的纯化
以下通用的实验方案适用于从血清,腹水,细胞培养液或其它生物样品中纯化抗体。
1. 振荡悬浮磁珠,吸取磁珠(如25µl,0.5mg)加入2ml灭菌离心管中,磁场吸附,弃去上清液;
2. 加500µl结合/洗涤缓冲液,洗涤磁珠,磁场吸附,弃去上清液;
3. 重复步骤2洗涤磁珠,磁场吸附,弃去上清液;
4. 将磁珠重悬于200µl结合/洗涤缓冲液,加入50µl血清(血清加入前可能需要稀释,以减少非特异性结合;稀释的程度可根据特定的应用进行优化),轻柔振荡悬浮,在室
温下孵育15分钟;
5. 磁场吸附,弃去上清液;
6. 加入结合/洗涤缓冲液(每次1000µl)洗涤3次,磁场吸附,弃去上清液;在最后一个洗涤过程中将磁珠转移到一个干净的试管,以避免粘在管壁上的蛋白质在下一步被一
起洗脱下来;
7. 加入50µl洗脱液,轻微振荡悬浮,室温洗脱10分钟;
8. 磁场吸附,将洗脱液转移到一个新试管中。加入5µl中和缓冲液以中和pH值。纯化的抗体可直接使用或贮存于2-8℃。
B. 靶抗原的免疫沉淀
以下通用的实验方案适用于从细胞裂解物等生物样品中免疫沉淀靶抗原。建议每200µl含200〜500µg总蛋白的细胞粗裂解物使用25µl 磁珠。如果无需裂解细胞可跳过第一
步。免疫沉淀可选择直接法或间接法。
1. 裂解细胞
1.1. 用PBS洗涤附在培养皿上的细胞;
1.2. 加入500µl预冷却的细胞裂解缓冲液以裂解细胞;
1.3. 从培养皿刮下细胞,超声破碎5秒,重复4次,在4℃ 1000g离心5分钟,得到的上清液为细胞粗提液;
1.4. 检测总蛋白含量,使用细胞裂解缓冲液调整总蛋白浓度至约1mg/ml。
2. 免疫沉淀
2.1 直接法
a) 振荡悬浮磁珠,吸取25µl磁珠加入1.5ml灭菌离心管中,磁场吸附,弃去上清液;
b) 加500µl结合/洗涤缓冲液,洗涤磁珠,磁场吸附,弃去上清液;
c) 重复步骤b洗涤磁珠,磁场吸附,弃去上清液;
d) 将1-5µg抗体溶于200µl结合/洗涤缓冲液后,加入到含磁珠的离心管,并在室温下轻摇孵育10分钟,以使抗体和蛋白A/G磁珠结合,抗体的用量应根据该抗体的特性进行
优化;
e) 磁场分离,弃上清液;
f) 加入结合/洗涤缓冲液(每次1000µl)洗涤磁珠2次,磁场吸附,弃去上清液;
g) 加入200µl含靶抗原的细胞粗提液,在4℃下悬浮孵育1小时,孵育条件可根据特定的抗体-抗原反应进行优化;磁场吸附,弃去上清液;
h) 加入结合/洗涤缓冲液(每次1000µl)洗涤磁珠2次,磁场吸附,弃去上清液。
2.2 间接法
a) 加入1-5µg抗体至200µl细胞粗提液,4℃下轻摇孵育1hr,以使抗体和细胞粗提液中的靶抗原结合,孵育条件可根据特定的抗体-抗原反应进行优化;
b) 震荡悬浮磁珠,吸取25µl磁珠加入1.5ml灭菌离心管中,磁场吸附,弃去上清液;
c) 加500µl结合/洗涤缓冲液,洗涤磁珠,磁场吸附,弃去上清液;
d) 重复步骤c洗涤磁珠,磁场吸附,弃去上清液;
e) 将抗体和细胞粗提液孵育后的样品(见步骤a)加入到含磁珠的离心管,并在室温下轻摇孵育10分钟,抗原-抗体复合物与磁珠结合;磁场分离,弃上清液;
f) 加入结合/洗涤缓冲液(每次1000µl)洗涤磁珠2次,磁场吸附,弃去上清液。
3. 洗脱靶抗原
3.1 非变性洗脱:加入50µl洗脱液重悬磁珠,轻微振荡悬浮,室温洗脱5分钟;磁场吸附,将含靶抗原的洗脱液转移到一个新试管中,加入5µl中和缓冲液以中和pH值。
3.2 变性洗脱:加入30µl SDS-PAGE reducing sample buffer重悬磁珠,90℃变性蛋白5min。磁场分离,取含靶抗原的上清液进行SDS-PAGE凝胶电泳等检测。
C. 再生
在非变性洗脱条件下,本产品可反复使用。在多次反复使用后可能因杂质吸附导致结合量下降,本产品耐受pH13以下溶液,建议磁珠使用5次及以上、当抗体载量下降后进
行碱处理,以去除非共价结合的蛋白,提高磁珠对抗体的吸附量。
1. 将1mg磁珠置于0.5ml 0.05M NaOH溶液中15min;
2. 磁场分离,弃上清液;
3. 加入0.5ml结合/洗涤缓冲液洗涤磁珠;
4. 磁场分离,弃上清液,将磁珠重悬于结合/洗涤缓冲液,2-8℃保存。
A. 蛋白回收率低,会有什么原因?
1. 蛋白可能会降解。可在细胞裂解液中添加蛋白酶抑制剂;
2. 磁珠用量不足。增加磁珠的用量;
3. 样品中蛋白含量低。增加样品的浓度或体积;或使用低分子量过滤膜(例如截留分子量为3500 Dalton的过滤膜),以减少起始样品体积和增加蛋白的浓度;
4. 孵育时间不足。培养时间将取决于靶蛋白的浓度和抗原-抗体的亲和力;
5. 不正确的洗脱体积。洗脱液体积通常在100-200µl。如果蛋白浓度低时,可由较小体积洗脱。建议重复洗脱1-2次,最后合并洗脱液。
B. 在非变性洗脱中,使用低pH值洗脱液,蛋白没有完全洗脱下来,怎么解决?
1. 洗脱条件过于温和。增加洗脱所用的孵育时间;或增加洗脱液的体积。
2. 检查洗脱液的pH值,可使用pH值2.7-3.5的洗脱液洗脱。
C. 在洗脱样品中发现非特异性蛋白质,怎么解决?
1. 非特异性蛋白质结合到磁珠上。在结合/洗涤缓冲液中加入NaCl (50mM至350mM),减少非特异结合。
2. 也可在结合/洗涤缓冲液中添加洗涤剂,如0.01-0.1%的Tween-20,以减少非特异性结合。
3. 增加洗涤的步骤或洗涤缓冲液的体积。
4. 稀释样品。